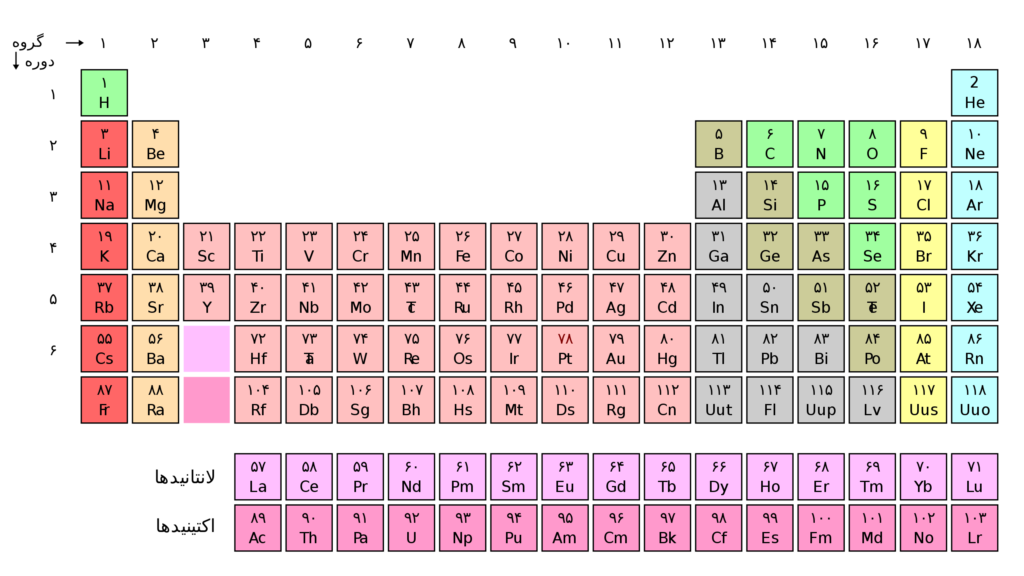
جدول تناوبی مندلیف که در همه کلاس های شیمی جهان به دیوار آویزان است یکی از شناخته شده ترین نمادهای این رشته تحصیلی است. صد و پنجاه سال پس از آنکه دیمیتری مندلیف ، شیمیدان روسی سیستم خود را برای مرتب سازی دقیق عناصر منتشر کرد ، جدول تناوبی ایجاد شد اما خانه های آن مانند جدول امروزی کامل نبود.
این جدول از ابتدا قابل تغییر بود و با کشف عناصر جدید رشد کرده است. همچنین با درک ویژگی های جدید عناصر و روابط آنها با یکدیگر ، ستون هایی به آن اضافه شده و شکل آن را تغییر داده است. ولی دانشمندان هنوز در مورد پیکربندی مطلوب آن بحث می کنند و احتمال تغییرات در این جدول همچنان وجود دارد.
برخی معتقدند خواص شیمیایی باید نحوه قرارگیری عناصر در جدول تناوبی را تعیین کند. برخی دیگر فکر می کنند یک اصل اساسی تر مانند پیکربندی الکترونیکی یا عدد اتمی نیاز است. برخی بر سر اینکه کدام عناصر به گروه ۳ تعلق دارند ، هلیوم باید به کجا برود و جدول تناوبی چند ستون داشته باشد ، درگیر هستند.
جداولی متفاوت با جدول تناوبی مندلیف !
در جدول تناوبی مندلیف ۳۲ ستونی که با عدد اتمی صعودی مرتب شده است ، لانتانیم (عدد اتمی ۵۷) از باریم (شماره ۵۶) برای شروع بلوک f دنبال می شود و اکتینیوم در زیر آن قرار دارد. این باعث می شود که لوتیتیوم اولین عنصر در ردیف سوم بلوک d باشد ، با اسکاندیم و ایتریوم در بالای آن و لارنسیوم در زیر گروه ۳ را تشکیل دهد.
جدول دیگری مشابه نسخه ۳۲ ستونی پیشنهاد شده است ، اما از پیکربندی الکترونیکی به جای اعداد اتمی به عنوان راهنمای اصلی خود استفاده می کند. با این حال ، جدول تناوبی ژانت ، دانشمند فرانسوی ، که در سال ۱۹۲۸ طراحی شده بود ، به این زودی در کتاب های درسی نخواهد آمد . او بلوک s را به سمت راست جدول منتقل می کند و هلیوم را در بالای گروه ۲ قرار می دهد زیرا مدار s آن ، مانند دیگر عناصر آن گروه ، پر شده است.
در جدول دیگر هلیوم را بالای گازهای نجیب قرار می دهند. قرار دادن هلیوم در سمت جدول تناوبی یکی از دلایلی است که خیلی مورد توجه قرار نگرفته است ، هرچند آزمایشات اخیر نشان می دهد که هلیوم می تواند پیوندهای پایداری ایجاد کند ، به استدلال ژانت مبنی بر تعلق آن به گروهی با عناصر واکنشی دیگر و نه بی اثر ، کمک می کند.
جدول تناوبی مندلیف چیست؟
در جدول تناوبی همه عناصر شیمیایی به ترتیب افزایش عدد اتمی – یعنی تعداد کل پروتون ها در هسته اتمی مرتب شده اند. هنگامی که عناصر شیمیایی به این ترتیب مرتب می شوند ، یک الگوی تکراری به نام “قانون دوره ای” در ویژگی های آنها وجود دارد ، که در آن عناصر موجود در یک ستون (گروه) دارای ویژگی های مشابه هستند. کشف اولیه که توسط دیمیتری مندلیف در اواسط قرن نوزدهم انجام شد ، در توسعه شیمی ارزش بی نظیری داشته است.
در واقع تا دهه دوم قرن بیستم به رسمیت شناخته نشده بود که ترتیب عناصر در سیستم تناوبی از نظر تعداد اتمی آنهاست ، که اعداد صحیح آنها برابر با بارهای الکتریکی مثبت هسته های اتمی است که در واحدهای الکترونیکی بیان شده است.
در سالهای بعد پیشرفت بزرگی در توضیح قانون دوره ای از نظر ساختار الکترونیکی اتمها و مولکولها حاصل شد. این شفاف سازی ارزش جدول تناوبی را افزایش داده است ، که امروزه به همان اندازه در آغاز قرن بیستم ، که تنها رابطه شناخته شده بین عناصر را بیان می کرد ، مورد استفاده قرار می گیرد.
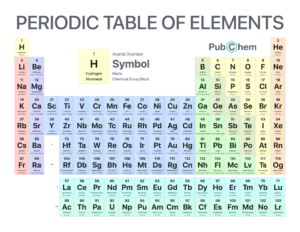
هر آنچه باید در مورد ویژگی و کاربردهای جدول تناوبی مندلیف بدانید؟
ویژگی های جدول تناوبی مندلیف
جدول تناوبی عناصر شیمیایی کلیه عناصر شیمیایی کشف شده را در ردیف (به نام دوره) و ستون (به نام گروه) با توجه به افزایش عدد اتمی ، سازماندهی می کند. دانشمندان از جدول تناوبی برای ارجاع سریع اطلاعات مربوط به یک عنصر مانند جرم اتمی و نماد شیمیایی استفاده می کنند. ترتیب جدول تناوبی به دانشمندان این امکان را می دهد تا روند ویژگی های عناصر ، از جمله بار الکتریکی ، انرژی یونیزاسیون و شعاع اتمی را تشخیص دهند.
بسیاری از دانشمندان روی مشکل سازماندهی عناصر کار کردند ، اما دیمیتری مندلیف اولین نسخه خود از جدول تناوبی را در سال ۱۸۶۹ منتشر کرد و اغلب به عنوان مخترع آن شناخته می شود. از آن زمان ، جدول تناوبی تکامل یافته است تا بیش از ۱۵۰ سال پیشرفت علمی و درک در شیمی و فیزیک را منعکس کند. امروزه این جدول با ۱۱۸ عنصر شناخته شده ، به طور گسترده ای به عنوان یکی از مهمترین دستاوردهای علم شناخته می شود.
ساختار جدول تناوبی مندلیف
ساختار جدول تناوبی امکان مشاهده روابط بین عناصر را در یک نگاه و پیش بینی خواص عناصر ناآشنا ، تازه کشف شده یا کشف نشده را ممکن می سازد.
دوره ها
هفت ردیف از جدول تناوبی وجود دارد که به آنها دوره می گویند. عدد اتمی عناصر از چپ به راست در یک دوره افزایش می یابد. عناصر سمت چپ یک دوره فلزات هستند ، در حالی که عناصر سمت راست غیر فلز هستند. حرکت یک دوره در جدول یک پوسته الکترون جدید به آن اضافه می کند.
گروه ها
ستون عناصر را گروه یا خانواده می نامند. گروه ها از ۱ (فلزات قلیایی) تا ۱۸ (گازهای نجیب) شماره گذاری می شوند. عناصر دارای یک گروه دارای پیکربندی الکترون ظرفیت هستند. عناصر درون یک گروه الگویی را با توجه به شعاع اتمی و انرژی یونیزاسیون نشان می دهند.
شعاع اتمی با حرکت به سمت پایین گروهی افزایش می یابد و الکترون های ظرفیت را از هسته دور می کند. با حرکت به سمت پایین گروه ، عناصر به طور پی در پی انرژی یونیزاسیون کمتری دارند زیرا حذف الکترون از بیرونی ترین پوسته آسان تر می شود.
بلوک ها
بلوک ها بخش هایی از جدول تناوبی هستند که زیر پوسته الکترون بیرونی اتم را نشان می دهند. بلوک s شامل دو گروه اول (فلزات قلیایی و قلیایی خاکی) ، هیدروژن و هلیوم است. بلوک p شامل گروه های ۱۳ تا ۱۸ است. بلوک d شامل گروه های ۳ تا ۱۲ است که فلزات انتقالی هستند. بلوک f شامل دو دوره زیر بدنه اصلی جدول تناوبی (لانتانیدها و اکتینیدها) است.
فلزات ، فلزات ، غیر فلزات
سه دسته وسیع عناصر عبارتند از فلزات ، متالوئیدها یا نیمه فلزات و غیر فلزات. نماد فلزی بیشتر در گوشه سمت چپ پایین جدول تناوبی قرار دارد، در حالی که بیشتر عناصر غیر فلزی در گوشه سمت راست بالا قرار دارند.
اکثر عناصر شیمیایی فلزات هستند. فلزات معمولاً براق (براق فلزی) ، سخت ، رسانا و قادر به تشکیل آلیاژها هستند. غیر فلزات نرم ، رنگی ، عایق و قادر به تشکیل ترکیبات با فلزات هستند. متالوئیدها بین فلزات و غیر فلزات خواص متوسطی را نشان می دهند. در سمت راست جدول تناوبی ، فلزات به غیر فلزات تبدیل می شوند.
یک الگوی پله ناهموار وجود دارد که از بور شروع می شود و از طریق سیلیکون ، ژرمانیوم ، آرسنیک ، آنتیموان ، تلوریم و پولونیوم می گذرد – که متالوئیدها را مشخص می کند. با این حال ، شیمیدانان به طور فزاینده ای عناصر دیگر را به عنوان متالوئیدها ، از جمله کربن ، فسفر ، گالیم و سایر موارد طبقه بندی می کنند.









