الکترونهای ظرفیت الکترون های s و p در بیرونی ترین پوسته هستند. وقتی اتم های یک عنصر را مطالعه و مشاهده می کنیم با ذرات زیر اتمی به نام الکترون ظرفیت مواجه می شویم. ساختارهای لوئیس به ما کمک می کنند تا الکترون های ظرفیت را ردیابی کنیم و انواع پیوندها را پیش بینی کنیم.
الکترونهای ظرفیت در اوربیتال ها یا پوسته های مختلف قرار گرفته اند و عمدتاً ذرات با بار منفی هستند. این الکترون ها مسئول برهمکنش بین اتم ها و تشکیل پیوندهای شیمیایی هستند. با این حال، همه الکترون ها با پیوندهای اتمی مرتبط نیستند. فقط الکترون های موجود در بیرونی ترین پوسته می توانند در تشکیل یک پیوند شیمیایی شرکت کنند. به این نوع الکترون ها، الکترونهای ظرفیتی می گویند.
الکترونهای ظرفیت و هسته ای
الکترون ها در اوربیتال های اطراف یک هسته وجود دارند. این اوربیتال ها و انرژی لازم برای حذف هر یک از این الکترون ها از اتم توسط مکانیک کوانتومی تنظیم می شود. هر یک از این اوربیتال ها برای ایجاد پوسته ای از الکترون ها در اتم عمل می کنند. الکترون های ظرفیت الکترون هایی هستند که به دور هسته در بیرونی ترین لایه اتمی یک اتم می چرخند. الکترون هایی که به هسته نزدیک تر هستند و در اوربیتالهای پر قرار دارند الکترونهای هسته ای نامیده می شوند.
الکترونهای ظرفیت دورترین الکترونها از بار مثبت (پروتونها) هستند و بنابراین حذف آنها راحت تر از الکترون های هسته است. این بدان معناست که برای دور شدن از اتم انرژی کمتری از آنها می گیرد. این تفاوت ناشی از این است که نیروی الکتریکی یک قانون مربع معکوس است. علاوه بر این، الکترون های هسته در لایه های داخلی سطوح انرژی کمتری نسبت به الکترونهای ظرفیتی دارند که لایه بیرونی را اشغال می کنند. این بدان معناست که الکترونهای موجود در لایههای داخلی می توانند انرژی را جذب کرده و به پوسته الکترون ظرفیتی حرکت کنند.
تعریف الکترونهای ظرفیت
ظرفیت به تعداد الکترون هایی اشاره دارد که یک اتم باید از دست بدهد یا به دست آورد تا به نزدیکترین پیکربندی الکترونیکی گاز نجیب یا گاز بی اثر برسد. الکترونهای ظرفیت نقش قابل توجهی در واکنشهای شیمیایی دارند زیرا در مقایسه با الکترون های موجود در مدارهای داخلی اتم انرژی بیشتری دارند. تعداد الکترونهای ظرفیت خواص شیمیایی یک عنصر خاص، مانند ظرفیت آن در تشکیل پیوند با عناصر دیگر را مشخص می کنند.
ویژگی های الکترون ظرفیت
الکترون ها در پیوندهای شیمیایی و واکنش های اتم نقش دارند. تعداد الکترونهای ظرفیت یک اتم را می توان از جدول تناوبی به دست آورد زیرا با عدد گروهی که عنصر در آن قرار دارد برابر است. اگر اتم ها دارای لایه ظرفیتی پر از الکترون ها باشند، پایدارتر هستند. اتم ها الکترونها را به گونه ای انتقال میدهند یا به اشتراک می گذارند که بتوانند به یک پوسته پر از الکترون دست یابند.
برخی از ویژگی های کلیدی یک الکترونهای ظرفیت عبارتند از:
- برای عناصر گروه اصلی، الکترون ظرفیت فقط در بیرونی ترین لایه الکترونی وجود دارد.
- یک الکترون ظرفیتی می تواند در پوسته داخلی یک فلز واسطه وجود داشته باشد.
- اتمی متشکل از پوسته بسته ای از الکترونهای ظرفیت معمولاً از نظر شیمیایی بی اثر خواهد بود.
- یک الکترون ظرفیتی می تواند انرژی را به شکل فوتون جذب یا آزاد کند.
- الکترون های ظرفیت رسانایی الکتریکی یک عنصر را نیز تعیین می کنند. بسته به این ماهیت عناصر می توانند فلزی، غیرفلزی یا متالوئیدی باشند.
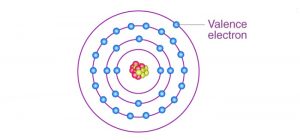
الکترون ظرفیت چیست و چه نقشی در واکنش شیمیایی دارد؟
تعیین الکترونهای ظرفیت
ساده ترین روش برای یافتن الکترونهای ظرفیت، بررسی مکان عناصر در جدول تناوبی است. الکترونهای ظرفیت یک عنصر را می توان با بررسی ستون عمودی که عناصر در آن قرار گرفته اند، پیدا کرد. راه دیگری که برای تعیین الکترون های ظرفیت می توانید، استفاده کنید دانستن پیکربندی الکترونیکی اتم است.
با این حال، اگر فلزات واسطه را در نظر بگیریم (گروه های ۳-۱۲)، پیدا کردن الکترون ظرفیت بسیار پیچیده است. زیرا ساختار اتمی این عناصر سفت و سخت است و زیر پوسته d ناقص است و پایین تر از پوسته بیرونی قرار دارد.
برای اتم های خنثی، تعداد الکترون های ظرفیت برابر با عدد گروه اصلی اتم است. شماره گروه اصلی یک عنصر را می توان از ستون آن در جدول تناوبی پیدا کرد. برای مثال کربن در گروه ۴ قرار دارد و دارای ۴ الکترون ظرفیت است. اکسیژن در گروه ۶ قرار دارد و دارای ۶ الکترون ظرفیت است.
بطورکلی تعداد کل الکترون های موجود در مدار آخرین لایه به عنوان الکترون ظرفیت شناخته می شود. به عنوان مثال اکسیژن دارای ۶ الکترون در آخرین لایه مداری است، بنابراین ظرفیت الکترونی آن ۶ است.
الکترون های ظرفیت و واکنش های شیمیایی
در واکنش های شیمیایی، الکترونها حتی می توانند از لایه ظرفیت آزاد شوند که می تواند باعث ایجاد پیوند یونی یا تبدیل شدن به یون باشد. هنگامی که یک الکترون از یک اتم خنثی خارج می شود، بار منفی خود را از دست می دهد و به یک یون با بار مثبت تبدیل می شود. به عنوان مثال، سدیم (Na) دارای یک الکترون در لایه بیرونی خود است. بنابراین میخواهد یک الکترون را از دست بدهد و به یون Na+ تبدیل شود.
یک اتم همچنین می تواند یک الکترون به دست آورد (معمولاً برای پر کردن لایه ظرفیت خود) و تبدیل به یک یون با بار منفی شود. این را می توان در کلر مشاهده کرد که در حالت خنثی، یک الکترون موجود در لایه الکترونی ظرفیت خود از دست می دهد. بنابراین، میخواهد یک الکترون بگیرد و به یون کلر تبدیل شود.
گازهای نجیب عناصری هستند که دارای پوسته ظرفیت کامل هستند، به این معنی که لایه بیرونی کاملاً با الکترون پر شده است. گازهای نجیب نمی خواهند الکترون به دست آورند یا از دست بدهند، به این معنی که از نظر شیمیایی بی اثر هستند (غیر واکنشی). به طور کلی، اتم ها می خواهند پوسته های الکترونی ظرفیت کامل داشته باشند. به همین دلیل است که اتمها و همچنین ترکیبات شیمیایی، الکترونهایی را از دست میدهند یا به دست میآورند تا تبدیل به یون شوند و همچنین پیوندهای یونی و کووالانسی تشکیل میدهند.
الکترونهای ظرفیت و پیوندهای شیمیایی
در هر دو پیوند یونی و کووالانسی حاصل الکترونهای ظرفیت هستند که در این پیوندهای شیمیایی شرکت می کنند. در پیوندهای تک کووالانسی، به طور معمول هر دو اتم در پیوند، هر کدام یک الکترون ظرفیتی را به منظور تشکیل یک جفت الکترون مشترک به مشارکت می گذارند. از الکترون های ظرفیت برای تشکیل پیوندهای دوگانه و سه گانه نیز استفاده می شود.
در پیوند یونی، الکترونهای ظرفیت به طور کامل بین اتم ها منتقل می شوند. این نوعی پیوند شیمیایی است که دو یون با بار مخالف، یکی آنیون و یک کاتیون تولید می کند. پیوند یونی بسیار رایج است زیرا فلزات دارای الکترون های کمی در اوربیتال های ظرفیت خود هستند و نافلزات تقریباً دارای ۸ الکترون در لایه ظرفیت خود هستند. فلزات الکترونهای ظرفیت خود را از دست می دهند و با رعایت قاعده اکتت پایدارتر می شوند. به طور مشابه، نافلزات به آسانی الکترون ها را برای دستیابی به پیکربندی گاز نجیب می پذیرند.









