
در حال حاضر سه تعریف برای اسید و باز وجود دارد که مستلزم نحوه رفتار آنها در هنگام قرار دادن در محلول ها است. این تعاریف عبارتند از تعریف اسید و باز لوئیس، برونستد-لوری و آرنیوس. در علم شیمی اساساً اسیدها جفت الکترون را می پذیرند و پروتون های هیدروژن را اهدا می کنند. در مقابل، بازها الکترون اهدا می کنند و پروتون های هیدروژن را می پذیرند. علاوه بر این تعاریف، اسیدها و بازها را می توان بر اساس ویژگی هایشان نیز طبقه بندی کرد. این خواص عبارتند از pH، طعم، بافت، واکنش پذیری و رسانایی.
تعاریف اسید و باز
دانشمندان مختلف اسیدها و بازها را به روش های مختلفی تعریف کرده اند. این تعاریف عبارتند از:
تعریف آرنیوس: هنگامی که یک اسید در آب حل می شود، H+ را به محلول و یک باز OH- را به محلول اهدا می کند.
تعریف لوئیس: یک اسید یک جفت الکترون را می پذیرد، یک باز یک جفت الکترون اهدا می کند.
برونستد – لوری : وقتی یک اسید حل شود، H+ را به محلول و یک باز OH- را به محلول اهدا می کند.
همانطور که می بینید تعاریف آرنیوس و برونستد – لوری اساساً یکسان هستند، تنها تفاوت این است که تعریف آرنیوس نیاز دارد که حلال آب باشد. در حالی که تعریف برونستد – لوری اینطور نیست.
در نتیجه محلول های اسیدی دارای غلظت بالایی از پروتون های هیدروژن هستند. در حالی که محلول های بازی دارای غلظت بالایی از یون های هیدروکسید هستند. هنگامی که این دو محلول با هم ترکیب می شوند، در واکنشی که به آن واکنش خنثی سازی می گویند، یکدیگر را خنثی می کنند. در این واکنش، محصولات نمک و آب هستند که از ترکیب پروتون های هیدروژن و یون های هیدروکسید تشکیل می شوند.
مقایسه اسید و باز
دو طبقه بندی برای مقایسه قدرت اسیدها و بازها وجود دارد. این دسته بندی براساس ضعیف بودن یا قوی بودن ماده است. در علم شیمی معمولاً ۶ اسید قوی و ۶ باز قوی در نظر گرفته می شود. جدول زیر اسید و باز های قوی را به شما نشان می دهد.
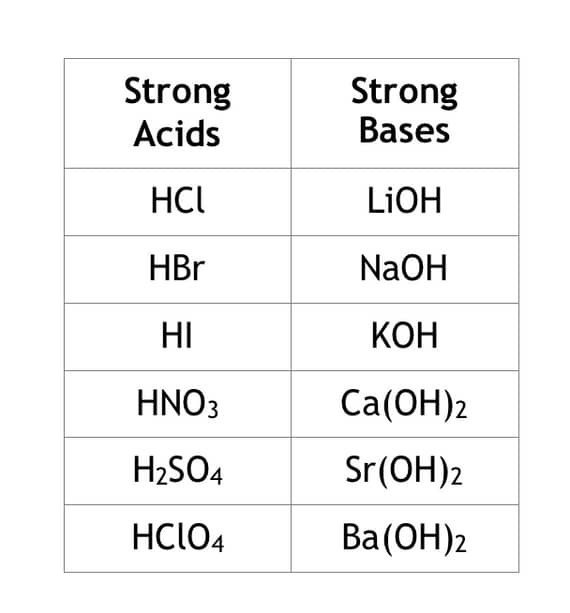
جدول مقایسه اسید و باز
اسیدها وقتی در محلول قرار می گیرند، کاملاً یونیزه می شوند. به عبارت دیگر اگر ۱ مول اسید کلریدریک HCl را در آب حل کنید، ۱ مول یون H+ و ۱ مول یون Cl- وجود خواهد داشت. همین امر برای هر یک از بازها نیز صادق است. از طرف دیگر اسیدها و بازهای ضعیف، ۱۰۰ درصد تفکیک نمی شوند.
PH اسید و باز
مقیاس pH معیار اسیدی یا بازی بودن یک محلول را نشان می دهد و از ۰ تا ۱۴ متغیر است. در این مقیاس، محلول های اسیدی دارای pH کمتر از ۷ هستند. در حالی که PH بازها بالاتر از ۷ است. محلول هایی با pH 7 مانند آب (H ۲ O) خنثی در نظر گرفته می شوند. روش های مختلفی برای اندازه گیری pH محلول وجود دارد. اما دو روش رایج استفاده از نشانگر و پروب است. پروب ها دقت بیشتری دارند، زیرا دستگاه در محلول قرار می گیرد و به صورت دیجیتالی خوانده می شود.
در هنگام استفاده از نشانگر ها، باید از چشمان خود برای مشاهده هرگونه تغییر رنگ و مقایسه آن با مقیاس pH استفاده کنید. یکی از انواع نشانگرها، کاغذ تورنسل است. اسیدها، کاغذ تورنسل آبی را قرمز و بازها کاغذ تورنسل قرمز را آبی می کنند.
طعم و بافت اسید و باز
یکی دیگر از ویژگی های تعیین کننده بین اسیدها و بازها طعم و بافت است. لازم به ذکر است همیشه باید دستورالعمل های ایمنی آزمایشگاه را دنبال کنید و هرگز این مواد شیمیایی را مصرف نکنید یا مستقیما به آنها دست نزنید. قبل از اینکه این مقررات برای محافظت از ما وضع شود، شیمیدان ها طعم مواد شیمیایی را می چشیدند.
در واقع، فیزیکدان و ریاضیدان معروف، آیزاک نیوتن، بیش از صد ماده شیمیایی مختلف را هنگام تمرین کیمیا چشیده است. در این میان عنصر جیوه که بسیار سمی است منجر به مرگ او شد.
همانطور که قبلا ذکر شد، محلول های اسیدی دارای غلظت بالایی از یون های هیدروژن هستند. این امر باعث می شود اسیدها طعم ترش و تیزی داشته باشند. اگرچه هرگز نباید اسیدی را در آزمایشگاه مصرف کنید، اما می توانید این را به طعم لیمو ترش ربط دهید.
لیموها اسیدی هستند، زیرا حاوی مقادیر زیادی اسید سیتریک هستند. علاوه بر این، لیمو دارای pH حدود ۲-۳ است، که در مقیاس pH به خوبی در دسته اسیدی قرار می گیرد. در مورد بازها باید بدانید که طعم تلخی دارند. یک مثال از بازها می تواند این باشد که طعم حباب صابون می دهند.
هرگز نباید عمداً مواد شیمیایی را روی پوست خود لمس کنید زیرا می توانند مضر و خورنده باشند. با این حال، اگر مایل به انجام این کار هستید، می توانید بر اساس لمس، تشخیص دهید که ماده مورد نظر شما اسید است یا باز. اگر محلول مورد نظر شما، صابونی یا لیز شد، یک باز است. به همین دلیل است که بازها روغن های اسید چرب پوست ما را حل می کنند و اساساً پوست ما را لیز می کنند. در همین حال، اسیدها معمولاً هنگام لمس خشن هستند.
واکنش پذیری اسید و باز
واکنش با فلزات
هنگامی که اسیدها با فلزات واکنش می دهند، نتیجه بسیار شبیه به واکنش خنثی سازی است. تنها تفاوت این است که به جای تولید آب، گاز هیدروژن تولید خواهد شد. برای مثال واکنش بین منیزیم و اسید هیدروکلریک است. هنگامی که این مواد با هم ترکیب شوند، محصولات به دست آمده عبارتند از کلرید منیزیم و گاز هیدروژن.
در مورد بازها، این مواد معمولاً با فلزات واکنش نشان نمی دهند. اما چند استثنا وجود دارد، مانند فلز روی و آلومینیوم که با بازها واکنش نشان می دهند. این واکنش ها همچنین منجر به تولید نمک و گاز هیدروژن می شود.
واکنش با کربنات ها
اسیدها همچنین می توانند با کربنات ها واکنش دهند که در این صورت نمک، آب و دی اکسید کربن تولید می کنند. کربنات ها هنگام ترکیب با فلزات یا ترکیبات آلی تشکیل می شوند. ویژگی منحصر به فرد در این واکنش، تولید دی اکسید کربن است. به سادگی محلول کربنات را به ماده مورد نظر خود اضافه کنید و اگر دی اکسید کربن تولید شد، محلول شما اسیدی است.
واکنش با چربی ها
فرآیند انحلال چربی ها و روغن ها، هیدرولیز نامیده می شود و در صورت حضور یک باز به عنوان صابونی شدن شناخته می شود. اساساً انجام این واکنش به این معنی است که بازها با چربی ها ترکیب می شوند و گلیسرول یا صابون را تشکیل می دهند.
رسانایی اسیدها و بازها
در طول این مقاله، ما در مورد چگونگی یونیزه شدن اسیدها و بازها به پروتون های هیدروژن و یون های هیدروکسید، هنگامی که در یک محلول قرار می گیرند صحبت کرده ایم. الکترولیت ها، مولکول هایی هستند که به طور کامل در مواد قطبی مانند آب یونیزه می شوند. به همین دلیل اسیدها و بازهای قوی نیز، الکترولیت های قوی هستند. این الکترولیت ها قادرند، الکتریسیته را در حالت های آبی خود هدایت کنند، زیرا یون های آنها محرک جریان الکتریسته است.









